Mitglied bei
Eine weitere Suchmöglichkeit besteht darin, z.B. bei www.google.de das Suchwort einzugeben und dann nach einem Leerzeichen den Zusatz site:www.cfs-aktuell.de
Sie erhalten dann alle Seiten auf cfs-aktuell.de, auf denen der gesuchte Begriff vorkommt.
Artikel des Monats Januar 2012 Teil 3
Michael Snyderman berichtet über seine antiretrovirale Behandlung
|
Bitte beachten Sie: 2012 hat sich herausgestellt, dass dieses XMRV keine Humaninfektion, sondern eine im Labor entstandene Chimäre war. Näheres unter Artikel des Monats Dezember 2012 - 1 auf dieser Website! |
|
Dr. Michael Snyderman ist Onkologe und leidet selbst an CFS und einem Blutkrebs, an Chronisch Lymphatischer Leukämie (1). Er ist XMRV-positiv und behandelt sich seit etwa anderthalb Jahren mit antiretroviralen Mitteln. Seine Blutwerte haben sich verbessert und seine Symptomatik ist zurückgegangen. Er beschreibt hier auf Jamie Deckoff-Jones' Blog vom 15. Dezember 2011 seine Behandlung und seine Fortschritte. Zitate aus der anschließenden Diskussion finden Sie im blauen Kasten. Übersetzung Regina Clos, Anmerkungen d.Ü. in Eckklammern |
|
"Es gibt einen Virologen an der Universität von Pittsburgh, mit dem ich Kontakt aufgenommen habe, weil der Wissenschaftler MLRVs bei Prostataerkrankungen identifiziert hat. Der Wissenschaftler hat mir per Email mitgeteilt, dass Kollegen ihm geraten haben, diese Forschung nicht durchzuführen und dass keine Zeitschrift bereit wäre, positive Ergebnisse zu veröffentlichen. Ein anderer bekannter Forscher der anfänglich positive Ergebnisse mit MLRVs hatte, hat mir anvertraut, dass Post-Doktoranden jedes Projekt im Zusammenhang mit MLRVs weggenommen wurde, um ihre berufliche Laufbahn zu schützen. Ich finde das sehr beängstigend für uns, denn es bedeutet, dass die Leute möglicherweise eine mit MLRV in Zusammenhang stehende Krankheit haben. Es sind nur sehr wenige mutige Wissenschaftler übrig wie Dr. Lipkin, die bereit sind, die Forschung fortzusetzen, um ein Virus zu finden." "Ich fühle mich nicht dazu qualifiziert, etwas in Bezug auf antiretrovirale Medikamente (AVRs) zu raten. Ich werde weitere AVRs ausprobieren und meine Ergebnisse mitteilen. Ich glaube, dass humane Gamma-Retroviren (HGRVs) bei vielen verschiedenen Krebsarten eine Rolle spielen. Ich denke nicht, dass sie den Krebs verursachen, aber dass sie das Ausmaß an Bösartigkeit steigern können. Ich habe einen Patienten, der als Medizinstudent ein Hodgkin-Lymphom hatte und im Alter von 45 dann Prostatakrebs und der jetzt Symptome ähnlich wie bei CFS hat. Manche Leute würden das Fatigue bei Krebs nennen, aber für mich ist das CFS. Ich glaube, dass diese Viren relativ häufig vorkommen, aber manche Leute sind anfälliger dafür. Dr. Enlander plant eine Forschungsarbeit, die das untersucht. Wie ansteckend das Virus ist, würde deshalb von vielen Faktoren abhängen, aber wir glauben auf der Basis unserer Umfrage, dass es ansteckend ist. Eine größere Studie wird nötig sein, um unsere Ergebnisse zu bestätigen, und wir hoffen, dass unsere Studie dafür eine Unterstützung gewinnen kann." "... meine Überzeugung ist (aber das muss noch erforscht werden), dass HGRV das T-Zell-Klon und die Zytokine/Chemokine, die das T-Zell-Klon produziert, einen Teil der Pathologie bei CFS verursacht und auch das Wachstum von Krebs anregen kann." Michael Snyderman in Kommentaren zu Jamie Deckoff-Jones' Blogeintrag "Olive Branch" vom 29. Dezember 2011 |
An Wissenschaftler und die CFS-Gemeinde
Ich habe meine Ein-Person-Studie über die antiretrovirale Behandlung eines Patienten mit Chronisch Lymphatischer Leukämie und CFS aktualisiert. Ich mache diese Behandlung seit dem 27. Mai 2010. Mein erstes Ansprechen auf AZT und Raltegravir dauerte bis zum 7. März 2011, also 9,4 Monate an. Ich habe die Daten über den Rückfall bis zum Juli gesammelt, um sicherzustellen, dass ich genügend Parameter hatte. Ich habe am 18. Juli 2011 Tenofovir zur Behandlung hinzugefügt. Meine Leukämiezellzahlen sind bei etwa 25% der Rate, die ich für den jetzigen Zeitpunkt prognostiziert habe. Meine letzte Blutuntersuchung wurde am 12. Dezember 2011 durchgeführt, wobei nur die Gesamtleukozytenzahl zurückkam und die anderen Parameter noch ausstehen. Es sind nun 4,5 Monate vergangen, seitdem ich das Tenofovir hinzugefügt habe. Bevor ich mit den antiretroviralen Mitteln begonnen habe, war ich so krank, dass ich dachte, ich müsste mich zur Ruhe setzten. Seitdem ich die Behandlung begonnen habe, bin ich zwar nicht vollkommen gesund, aber ich funktioniere – 17,8 Monate, nachdem ich die erste Dosis eingenommen habe.
Ich stimme zu, dass XMRV nicht der Erreger ist, aber dass meine Resultate in der Tat zeigen, dass ein Retrovirus einen Teil der Ätiologie sowohl der Leukämie als auch des CFS ausmachen. Es ist eine Ein-Personen-Studie, aber meine Leukämie und mein CFS sind recht typisch, und es gibt überhaupt nichts Ungewöhnliches, das nahe legen würde, dass die Ergebnis nicht eine Einsicht in das erlauben würden, was mit uns passiert. Der Artikel wird für eine Publikation eingereicht, wenn meine Untersuchungen auf die Virusintegration zur Verfügung stehen, hoffentlich in den nächsten Monaten. Ich werden dann einen Titel, ein Abstract und einen Abschnitt über die Methoden bis zu diesem Zeitpunkt hinzufügen.
Meine Schlussfolgerung ist, dass eine weitere Erforschung eindeutig angezeigt ist und dass es sehr vernünftig wäre, wenn die Regierung dazu gebracht würde, diese Forschung zu finanzieren.
Hier sind ein paar häufig gestellte Fragen, die ich für hilfreich halte:
1. Ist es unmoralisch, mich selbst mit antiretroviralen Mitteln (ARVs) zu behandeln? Nein.
Als Onkologe kenne ich den Wert oder mangelnden Wert aller standardmäßigen Behandlungsoptionen für Chronisch Lymphatische Leukämie. Ich versuche nicht, die Kosten für die Behandlung von irgendeiner dritten Partei erstattet zu bekommen und ich benutze keine illegalen Medikamente. Es gibt keinen damit verbundenen finanziellen Gewinn.
2. Könnte meine Reaktion die Folge von selektiver Toxizität (1) der AVRs sein? Nein
Von den vielen Krebsmitteln, die in den vergangenen 50 Jahren entwickelt wurden, hat keines eine komplett selektive (trennscharfe, gezielte) Toxizität gegen Krebs, die Toxizität sieht man niemals nur in Bezug auf den Krebs. Es gab im Zusammenhang mit meiner Behandlung keine Toxizität.
3. Könnte die Wirkung meiner AVRs eine chemotherapeutische Wirkung sein? Nein.
Es gibt keine klinischen Studien, die eine chemotherapeutische Aktivität für die Einzelsubstanzen AZT, Raltegravir oder Tenofovir behaupten würden.
4. Könne die Wirkung sekundär auf die Telomerasehemmung (1) durch AZT und Tenofovir zurückzuführen sein? Nein.
Das Ansprechen meiner Leukämiezellen innerhalb von vier Wochen ist zu rasch für einen Abbau von Telomeren und der Induktion des programmierten Zelltods (Apoptose). Die Anti-Telomerase-Verbindung Imetelstat (GRN 1631L) hat in klinischen Studien keine Einzelsubstanz-Aktivität gezeigt und man nimmt an, dass sie allenfalls ein Zytostatikum ist.
5. Könnte die Wirkung der AVRs in Wirklichkeit eine Anti-Herpes-Aktivität sein? Nein.
Eine Untersuchung meines Blutplasmas mit DNA-Assays auf EBV- und CMV-DNA waren negativ. Meine Lymphozyten wurden an der Mayo Clinic auf eine aktive EBV-Infektion getestet und waren negativ. Eine Untersuchung für eine aktive Herpesvirusinfektion mit CMV, EBV und HHV6 am WPI verlief negativ.
6. Da diese Behandlung von der gleichen Person durchgeführt und beschrieben wird, sind die Ergebnisse verlässlich? Ja.
Die Ergebnisse der Ermittlung der absoluten Lymphotzytenzahl sind in den Akten des Catholic Hospital System of Western NY festgehalten, und andere Parameter sind in den Akten von Quest. Ich werde jedem, der Kopien davon haben möchte, erlauben, diese direkt zu erhalten. Außerdem möchte ich, dass die Ergebnisse korrekt sind, da ich meine Behandlung nach diesen Ergebnissen festlege und eine Behandlung über meine Gesundheit und mein Überleben entscheidet,
7. Hat eine Ein-Personen-Studie überhaupt irgendeinen Wert? Ja.
Aufgrund von medizinisch-rechtlichen Überlegungen ist ein Arzt, der sich selbst behandelt, der beste Ausgangspunkt. Mein CFS und meine CLL sind typisch, und die positiven Ergebnisse lassen darauf schließen, dass eine weitere Untersuchung wichtig ist und auch einen vernünftigen Ausgangspunkt für ein Behandlungsprotokoll ergibt.
Michael Snyderman, MD
|
18 Monate Erfahrungen mit antiretroviralen Medikamenten bei einem Patienten mit CFS und Chronisch Lymphatischer Leukämie Einführung In den 1970ern haben drei unabhängige Labors das Vorhandensein eines MLRV (Murine leukemia related virus - Mäuseleukämie-verwandten Virus) bei Sarkomen, Leukämie und verschiedenen Leukämien beschrieben [1-6]. Das MLRV wurde nur in neoplastischen (1) und nicht in normalen Zellen gefunden und war dem Rauscher-Virus ähnlich. Die neuere Nomenkaltur bezeichnet diesen Virustyp als HGRV (Humanes Gamma Retrovirus). Überraschenderweise wurden die Arbeiten aus den 1970er Jahren für die nächsten 30 Jahre ignoriert, bis Urisman et al [7] im Jahr 2006 in einigen Prostatakrebsgeweben ein HGRV/MLRV entdeckten, das sie als XMRV bezeichneten. Im Jahr 2009 fanden Lombardi et al [8] am Whittemore Peterson Institute (WPI) Belege für eine Infektion mit HGRV/MLRVs, die dem XMRV ähnlich sind, bei den meisten der untersuchen Patienten mit Chronic Fatigue Syndrome (CFS). Derzeit werden die Virusfunde von Lombardi et al kritisiert, weil viele Labors nicht in der Lage waren, ihre Ergebnisse zu reproduzieren. Einige Retrovirologen haben unmissverständlich gesagt, dass HGRV/MLRVs nicht CFS verursachen.
Die Diagnose CFS wird durch die
Verwendung der Kanadischen Konsenskriterien für CFS und durch die
typische Erhöhung von Zytokinen und Chemokinen objektiviert [9]. Man
vermutet, dass es bei CFS-Patienten im Vergleich zur
Normalbevölkerung zu einem erhöhten Vorkommen von bösartigen
Lymphomen und Gehirntumoren kommt [10]. Die Schlussfolgerung daraus
ist, dass HGRV/MLRVs sowohl für CFS als auch für bösartige Tumoren
ätiologisch (krankheitsverursachend) sein könnten. Daniel Petersons
Praxis hatte 300 Patienten aus der 1984er CFS-Epidemie in Nevada in
Behandlung. Dreizehn Patienten aus dieser Kohorte entwickelten
verschiedene B-Zell-lymphoproliferative Erkrankungen, und alle
wurden positiv auf eine klonale T-Zell-Expansion getestet. Außerdem
wurden nach entsprechender Untersuchung durch das WPI bei ihnen
Belege für eine Infektion mit HGRV/MLRV gefunden, aber diese Daten
sind momentan in der Schwebe. Es wurde die Hypothese aufgestellt,
dass eine HGRV/MLRV-Infektion für die klonale T-Zell-Expansion
verantwortlich ist und dass diese klonale T-Zell-Expansion die
Entwicklung des CFS und der bösartigen Tumoren gefördert haben
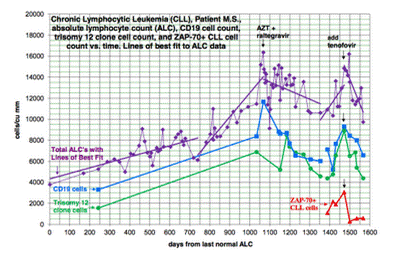
könnte. Ein Patient mit einer B-Zell-CLL wurde positiv auf Antikörper gegen MLRV-Proteine getestet. Untersuchungen auf eine Virusintegration stehen noch aus. Obwohl er zuvor nicht als CFS-Patient diagnostiziert worden war, erfüllte er die Kriterien für die Diagnose CFS nach den Kanadischen Konsenskriterien. Seine erhöhten Zykotin- und Chemokinwerte stimmten mit der Diagnose CFS überein. Er war außerdem positiv auf eine klonale T-Zell-Expansion, und zwar sowohl mit quantitativen als auch mit qualitativen Testverfahren auf das Vorliegen von klonalen TCRg-Gen-Rearrangementss. Er hatte durchschnittliche progrostische Faktoren, wobei der einzige potentiell ungünstige Faktor ein Trisomie-12-Klon war. Er wurde negativ auf EBV, CFM, HHV6A und HHV6B getestet. Er begann die Behandlung mit AZT und Raltegravir 571 Tage nach der Diagnose der Chronisch Lymphatischen Leukämie. Am 56. Tag der Behandlung hatten sich seine Zytokinwerte gebessert (Abbildung 1). Dies fiel zusammen mit einer Besserung der CFS-Symptome, d.h. der Erschöpfung, der Konzentrationsprobleme und der neuropathischen Schmerzen. Seine positive Reaktion setzte sich über 9,4 Monate fort, wobei es zu keiner damit zusammenhängenden toxischen Wirkung kam, und er war in der Lage, Vollzeit zu arbeiten. Seine zuvor ansteigenden absoluten Lymphozytenzahlen, die CD19-Zellen und die Trisomie-19-Zellen nahmen in diesem Zeitraum tendenziell ab. Zu Beginn der Behandlung mit AZT und Raltegravir war sein ALC bei 16,348/cu mm und die CD 19-Zellen bei 11,658/cu mm gestiegen von 3,303 zum Zeitpunkt der Diagnose. Seine Trisomie-12-Zellen waren am 117. Tag der Behandlung auf einen Spitzenwert von 8,490/cu mm gestiegen, verglichen mit 1,550 zum Zeitpunkt der Diagnose. Nach 285 Tagen der Behandlung waren die ACL-Zahlen auf 10,600/cu mm, die CD 19Zellen auf 6,015 und die Trisomie 12-Zellen auf 4,558 gesunken. In der Folge sind die Zahlen wieder schlechter geworden, trotz der Fortsetzung der Behandlung mit AZT und Raltegravir. Auch die Symptome des CFS verstärkten sich. Dann wurde Tenofovir zur Behandlung hinzugefügt und alle Parameter sowie auch die CFS-Symptome gingen wieder zurück (Abbildung 2). Die ALC erreichten in der dritten Woche der Behandlung einen Spitzenwert von 16,194 und waren in der 20. Woche auf 12,324 abgesunken. Der Ausgangswert der CD-19-Zellen lag bei 9,298, die Trisomie-12-Zell-Zahl lag bei 8,902 und die ZAP70-Zahl bei 3,068. In der 13. Woche war die CD-19-Zell-Zahl auf 6,570 gesunken, die Trisomie-12-Zahl auf 4,374 und die ZAP70-Zahl auf 591 gesunken. Die entsprechenden Werte für die 20. Behandlungswoche stehen noch aus. Quantitative Daten für die klonalen T-Zellen standen für den Zeitpunkt des Rückfalls zur Verfügung. Sie zeigten einen Anstieg der klonalen T-Zellen, der rascher zu sein schien als der Anstieg der CD-19_zellen, und nach dem Hinzufügen von Tenofovir gingen sowohl die klonalen T-Zellen als auch die CD-19-Zellen zurück, aber dabei schienen die klonalen T-Zellen rascher abzufallen (siehe Abbildung 3). Diskussion Die Entwicklung von bösartigen B-Zell-Lymphomen in 13 von 300 CFS-Patienten lässt darauf schließen, dass CFS-Patienten verglichen mit dem entsprechenden Auftreten in der Allgemeinbevölkerung ein mehrere hundertfach erhöhtes Risiko für bösartige Tumoren haben. Von diesen 13 Patienten waren alle positiv auf eine klonale T-Zell-Expansion. Sie wurden außerdem alle positiv auf eine Infektion mit HGRV/MLRVs getestet, aber diese Daten stehen jetzt infrage.
Das stark erhöhte Risiko für
B-Zell-Tumoren bei möglicherweise HGRV/MLRV-infizierten Patienten
könnte die Folge einer Infektion der B-Zell-Line durch HGRV/MLRVs
sein. Man nimmt an, dass Retroviren durch Insertionsmutagenese Krebs
verursachen. Dieser Mechanismus erfordert, dass die provirale DNA
des Retrovirus sich in die DNA des Wirts unmittelbar neben einem
Proto-Onkogen integriert und dadurch eine Aktivierung des
Proto-Onkogens verursacht. Ein noch wichtigerer Mechanismus der
Krebserzeugung durch MLRVs könnte die Fähigkeit von viralen
Proteinen sein, die Genexpression der Wirtszellen zu verändern. 24
bis 48 Stunden nach der Infektion einer permissiven Zelllinie mit
XMRV sind zahlreiche zelluläre Gene expremiert: “10 dieser Gene
spielen eine Rolle in der Zellmorphologie, 11 in der
Zellentwicklung, 12 in der Signalübertragung und Wechselwirkung
zwischen Zellen, 11 Gene in der zellulären Bewegung und 13 im
Zellwachstum und der Zellvermehrung“ [17]. Spadafaro hat gezeigt,
dass reverse Transkriptase eine Genaktivierung erzeugen und zu einem
bösartigen Phänotypus führen kann [18]. Bei einigen mit Retroviren
zusammenhängenden Tumoren können auch Env [19] und Gag [20] eine
wichtige Rolle bei der malignen Zellveränderung spielen. Literatur
|
|
Chronisch Lymphatische Leukämie Die chronische lymphatische Leukämie (CLL) ist eine Form des Blutkrebses, bei dem es zu einer klonalen Vermehrung von reifen, kleinzelligen aber funktionslosen B-Lymphozyten kommt. Sie ist in der westlichen Welt die am häufigsten vorkommende Leukämieform.
Selektive Toxizität bedeutet, dass die Erreger im Wirtsorganismus selektiv abgetötet oder an der Vermehrung gehindert werden, ohne dass die Zellen des Wirts durch die Chemotherapie oder antiinfektive Therapie geschädigt werden. Neoplasie Mit dem Begriff Neoplasie oder Neoplasma bezeichnet man die Neubildung von Körpergeweben. Damit kann sowohl die physiologische Regeneration eines Gewebes (z.B. von Epithelgewebe) gemeint sein, als auch die autonome, pathologische Gewebevermehrung eines Tumors. Klinisch wird "Neoplasie" am häufigsten als Gattungsbezeichnung für maligne Tumoren verwendet. Telomere sind die Enden der Chromosomen. Sie sind für die Stabilität von Chromosomen zuständig. |